


Flowering cycle of Chusquea mollis l.G. Clark (Poaceae, Bambusoideae, Bambusae, Chusqueinae) in the Venezuelan Andes
Francisca Ely(1)
José V. González(1)
(1) Instituto Jardín Botánico de Mérida, Facultad de Ciencias, Universidad de Los Andes, Avenida Alberto Carnevali, Núcleo Pedro Rincón Gutiérrez. Mérida, Venezuela. felyenator@gmail.com
Recibido: Agosto, 2019
Aceptado: Noviembre, 2019
Doi: http://dx.doi.org/10.24133/ciencia.v22i1.1411
En la mayoría de bambúes leñosos, existe mucha incertidumbre respecto a su ciclo de floración, dado que su frecuencia y duración varía según la forma de vida, distribución latitudinal y altitudinal. Los bambúes de ecosistemas andinos tropicales combinan eventos de floración gregaria sincrónicos y asincrónicos. El objeto del presente estudio era el de determinar el patrón de floración de Chusquea mollis, un bambú monocárpico, nativo de los páramos de Venezuela y Colombia. La cronología de eventos de floración de la especie se determinó mediante la consulta de bases de datos, exicatas de herbarios y registros de floración de dos poblaciones de la Cordillera de Mérida, Venezuela. La diversidad etaria de las poblaciones de bambúes también contribuye a determinar el patrón de floración; por lo que se realizó un censo en una población ubicada en el Páramo La Aguada. Nuestros resultados sugieren que C. mollis presenta un patrón fenológico mixto, que combina eventos de floración gregarios y asincrónicos, transcurrido un período vegetativo relativamente corto (5-7 años). La población estudiada presentó una marcada diversidad etaria, conformada por plántulas, juveniles, adultos vegetativos, en reproductivo y post-reproductivo, siendo los juveniles el grupo más numeroso
Palabras clave:
Bambúes leñosos, Magnifoliae, fenología reproductiva, estructura poblacional, páramos.
Flowering cycles are poorly understood in the majority of woody bamboos, since their frequency and duration may vary according their growth-form and distribution across latitude and altitude ranges. Tropical Andean bamboos are known for combining gregarious, synchronic and asynchronic flowering events. The main objective of this study was to determine the flowering pattern of Chusquea mollis a monocarpic, native bamboo that grows in the subparamos and paramos of Venezuela and Colombia. The chronology of flowering events of this species was based on the revision of herbarium specimens, online databases and the occurrence of flowering events in two populations of the Cordillera de Mérida, Venezuela. Taking in account that age diversity may also contribute to identify flowering patterns in bamboo populations; we performed a survey of a single population located in the Páramo La Aguada. Our results suggest that C. mollis combines gregarious and asynchronic flowering cycles, after a relatively short vegetative period (5-7 years). The census conducted in a single population of La Aguada revealed the co-existence of plantlets, juvenile plants, vegetative, reproductive and post-reproductive adults, of which the juvenile were the most numerous group.
Key words:
Woody bamboos, Magnifoliae, reproductive phenology, population structure, paramos.
El género Chusquea Kunth representa actualmente el género más diverso entre los bambúes leñosos neotropicales, con aproximadamente 185 especies descritas para la fecha (Clark et al., 2015; Fadrique et al., 2019). No obstante, se estima que este número incrementará próximamente, puesto que existe un número indeterminado de potenciales especies nuevas en los Andes tropicales.
Estudios moleculares recientes indican que la subtribu Chusqueinae está representada exclusivamente por el género Chusquea Kunth; el cual comprende cinco subgéneros: Chusquea Kunth, Rettbergia (Raddi) L.G. Clark, Swallenochloa (McClure) L.G. Clark, Platonia Fisher & L. G. Clark y Magnifoliae L. G. Clark & Fisher (Fisher et al., 2014). Los primeros tres subgéneros comparten caracteres vegetativos como múltiples yemas por nudo en los culmos, tallos aéreos rectos o arqueados, pero siempre ramificados, entrenudos elongados, revestidos por hojas caulinares persistentes o caducas y hojas del follaje de tamaño variable, pero generalmente inferiores a 40 cm (Judziewicz et al., 1999). En contraste, los dos subgéneros restantes, Platonia y Magnifoliae presentan culmos siempre erguidos, que portan una única yema por nudo, entrenudos muy cortos, hojas caulinares pobremente desarrolladas y hojas del follaje usualmente muy largas y erectas. Este conjunto de caracteres, considerados ancestrales en el grupo le brindan un aspecto de roseta, que en nada se asemejan a un bambú leñoso típico, razón por la cual todos sus representantes se ubicaban anteriormente en el género Neurolepis Meisn. (Fisher et al., 2009, 2014).
Las especies del género Chusquea se distribuyen desde el norte de México hasta el sur de Chile y Argentina; la mayoría están asociadas a ecosistemas boscosos montanos y pastizales de altura (Judziewicz et al., 1999; Clark et al., 2015). Las regiones que concentran la mayor diversidad de especies son los Andes tropicales, el Escudo Guayanés (Clark & Ely, 2011) y el sudeste de Brazil (Judziewicz et al., 1999; Fisher et al., 2014; Vorontsova et al. 2016). Las especies del género Chusquea que crecen a mayor elevación pertenecen a los subgéneros Swallenochloa, Magnifoliae y Platonia (Fisher et al,. 2014). En Venezuela, encontramos representantes de ambos subgéneros asociados a ecosistemas de alta montaña; concretamente, bosques nublados, subpáramos y páramos. Las especies del subgénero Magnifolia habitan principalmente páramos húmedos bajos o subpáramos, incluyendo la zona de contacto entre límite superior continuo de los bosques nublados y el páramo propiamente dicho (Ramírez et al., 2009; Clark & Ely, 2011), conocido como Bosque Paramero, donde crecen C. spectabilis L.G. Clark (2600-2900 m snm) y C. mollis (Swallen) L.G. Clark (2650-3400 m snm).
El subgénero Swallenochloa también tiene representantes en los páramos bajos o subpáramos (Chusquea angustifolia (Soderstrom & Calderón) L.G. Clark, C. spencei Ernst. y C. tessellata Munro 2600-2800 m snm); sin embargo, se diferencian de las especies del subgénero Magnifoliae por crecer en condiciones de mayor exposición, lo cual les permite colonizar el límite superior del páramo propiamente dicho (C. spencei 2700-3650 m snm), e inclusive, ascender hasta el superpáramo o páramo altiandino (C. guirigayensis Niño, Dorr & L.G. Clark, 3700-4010 m snm).
En los Andes venezolanos, los bambúes leñosos de los subgéneros Chusquea y Swallenochloa son elementos muy conspicuos del paisaje andino tanto en ecosistemas boscosos como parameros (Judziewicz et al., 1999; Cuello & Cleef, 2009; Cuello et al., 2010; Insuasty-Torres, 2015; Clark et al., 2015). En contraste, los representantes del subgénero Magnifolia como Chusquea mollis (Swallen) L.G. Clark y C. spectabilis L.G. Clark (= Neurolepis mollis Swallen y N. aperta (Munro) Pilger, respectivamente) no destacan del mismo modo, por el hecho que forman poblaciones pequeñas y muy discontinuas, por lo que no aportan de manera significativa a la cobertura de los bosques parameros, ni del páramo propiamente dicho (Ramírez et al. 2009; Ely comunicación personal). Por este motivo se incluyó a C. mollis en la lista de especies amenazadas de la IUCN (Ely & Clark, en prensa).
Los bambúes leñosos se han catalogados típicamente como monocárpicos; sin embargo, excepciones a esta regla son comunes en bambúes templados y tropicales, en los cuales sobrevive una proporción variable de ramets y rizomas después de la floración (Pearson et al., 1994; Judziewicz et al., 1999; Kitamura & Kawahara, 2009; Miyazaki et al. 2009; Montti el al., 2011; Clark et al., 2015; Ely, comunicación personal). Los ciclos de floración en bambúes leñosos varían en función de su forma de vida, la latitud y las características genéticas propias de cada especie (Franklin, 2004; Tachiki et al., 2015; Wang et al. 2016). A grandes rasgos, se reconocen tres patrones que se describen a continuación:
1- Floración gregaria, que consiste en la floración masiva de especies típicamente monocárpicas (Clark et al. 2015), cuya floración se sincroniza entre diferentes poblaciones de la misma especie, en un lapso que puede extenderse entre 1-7 años (Pearson et al., 1994; Judziewicz et al,. 1999; Franklin, 2004; Abe & Shibata, 2012; 2014; Dalagnol et al., 2018; Ely et al. 2019). En este tipo de eventos, la gran mayoría de las poblaciones concentran su floración en un mismo año, originando un pico de floración, producto de la activación de procesos regulatorios endógenos propios de la especie, que pueden estar influenciados por factores ambientales (Franklin, 2004). El tamaño y la distribución espacial de los genets, los procesos de competencia intraespecífica, limitaciones en la dispersión de los frutos y la reducción del fitness de la especia por entrecruzamiento pueden alterar la sincronización de las poblaciones, extendiendo la duración el evento de floración (Matsuo et al., 2014; Wang et al. 2016; Tachiki et al., 2015).
2- Floración esporádica o asincrónica, representa una variación una variación del patrón anterior, donde no se ha logrado establecer un patrón en especies monocárpicas, dada la asincronía en los ciclos floración (Judziewicz et al., 1999; Kitamura & Kawahara, 2009; Abe & Shibata, 2012; Mizuki et al. 2014; Wang et al., 2016). Las causas de esta asincronía no han sido dilucidadas con exactitud; entre los factores que se manejan está la modificación de procesos regulatorios endógenos (mutaciones, supresión y/o expresión de genes de floración y factores de transcripción) (Zhang et al., 2012; Zeng et al., 2015; Wysocki et al., 2016).
3- Continuos, que consisten en una variación del patrón anterior, pero se distinguen por la presencia en cualquier época del año de un número variable de genets fértiles en la población (Clark, 1989; Clark et al., 2015; Ely et al., 2109), los cuales también han sido catalogados como policárpicos (Miyazaki et al., 2009; Ma et al., 2013; Matsuo et al., 2014). En las especies de floración regular policárpica, los eventos de floración no siempre conllevan a senescencia y muerte del genet materno; tal es el caso de Guadua angustifolia Kunth y Guadua superba Huber (Judziewicz et al,. 1999; Londoño comunicación personal).
Los bambúes trepadores de bosques Atlánticos y nublados tropicales suelen seguir patrones de floración gregarios que se extienden un número variable de años con asincronía temporal entre poblaciones disyuntas de la misma especie (Pearson et al., 1994; Montti et al., 2011; Guerreiro, 2014). En contraste, los bambúes asociados a páramos y subpáramos presentan patrones de floración continuos (Clark, 1989; Judziewicz et al., 1999; Clark et al., 2015; Ely al., 2019). La elevada frecuencia de eventos de floración asincrónicos observados en bambúes de ecosistemas parameros puede involucrar en algunos casos hasta el 40% de los individuos de la población (González-Mora, 2018) y se han observado en todas las especies venezolanas del subgénero Swallenochloa (Ely, comunicación personal).
Los patrones de floración asincrónicos y/o continuos incrementan la diversidad etaria de la población, así como su diversidad genética (Ely et al., 2019; Ma et al., 2013; Matsuo et al., 2014). Los estudios fenológicos en bambúes leñosos son algo limitados para la fecha, a causa de la extendida vida vegetativa de la mayoría de sus especies, que puede alcanzar 120 años en bambúes asiáticos (Makita, 1998; Clark et al., 2015) y 10 a 45 años en bambúes americanos de ecosistemas boscosos (Pohl, 1982; Pearson et al., 1994; Judziewicz et al., 1999; Montti et al., 2011; Clark & Ely 2013, Guerreiro 2014). Hasta la fecha, no existen estudios detallados que involucren la fenología y dinámica poblacional en bambúes leñosos de ecosistemas andinos, cuyos ciclos de floración son presumiblemente cortos en representantes del subgénero Magnifoliae, dada la alta incidencia de individuos fértiles observados en campo (Ely, comunicación personal).
Observaciones de campo realizadas por la primera autora desde el año 2006 en diferentes poblaciones de Chusquea mollis en los Andes venezolanos sugieren que la especie obedece un patrón de floración estrictamente monocárpico, que conlleva a la senescencia y muerte del genet en un lapso generalmente de dos a tres años; sin embargo, no está claro si los eventos de floración ocurren de manera sincronizada o no. Tanto los eventos de floración sincrónicos como los asincrónicos contribuyen a mantener la diversidad genética en plantas clonales con ciclos de floración largos como los bambúes leñosos (Ely et al., 2019); sin embargo, su influencia en la composición etaria de la población debe variar, en función del patrón de floración de la especie. La floración gregaria sincrónica origina poblaciones de estructura etaria relativamente homogéneas, a diferencia de la floración asincrónica y/o continua que promueve poblaciones heterogéneas, con representación de diferentes grupos etarios.
Teniendo en consideración la complejidad de los patrones de floración en bambúes leñosos andinos y la escasa información disponible, nos planteamos analizar el patrón de floración de Chusquea mollis, en función de los siguientes objetivos:
1- Establecer el patrón fenológico de la especie y su duración, estimada a partir de los eventos de floración, basándonos en los registros de floración disponibles a partir de colecciones depositadas en herbarios e información recopilada en colecciones depositadas de diferentes salidas de campo realizadas desde el año 2006.
2- Establecer la composición etaria en una población determinada de la especie, asumiendo que los eventos de floración gregaria originan poblaciones de composición etaria homogénea y los asincrónicos poblaciones heterogéneas, para lo cual es necesario determinar la representatividad de cada grupo etario y su distribución en el bosque.
2.1. DESCRIPCIÓN DE LA ESPECIE
Chusquea mollis (Swallen.) L.G. Clark. Syst. Bot. 39(3). 2014. Sinónimo: Neurolepis mollis Swallen, J. Wash.
Bambúes cespitosos de rizomas paquimorfos, de 2-7 m de altura. Culmos erguidos (1,5-4 m x 0,4-1,5 cm),
firmes, no ramificados, con 1 yema/nudo; entrenudos de 2-5 mm de longitud, lisos, sólidos. Hojas caulinares poco
desarrolladas hasta ausentes. Hojas del follaje grandes (0,8-1,5 m x 4-6 cm), coriáceas. Panículas terminales,
espiciformes (40-100 cm de largo x 3-6 cm de ancho), espiguillas pardas, uniflosculadas, de 3,5 a 4,8 mm de largo,
no aristadas.
2.2. DISTRIBUCIÓN Y HÁBITAT
Chusquea mollis crece en subpáramos y páramos húmedos de Venezuela y Colombia, en un gradiente de
elevación situado entre 2450-3500 m snm (Judziewicz 1999, Cuello et al. 2010) asociado a claros del bosque
paramero y cañadas. En Venezuela, la distribución de esta especie es muy discontinua y se restringe a páramos
húmedos de los estados Mérida (Mun. Libertador y Obispo Chacón, páramos La Aguada y Las Coloradas, Parque Nacional Sierra Nevada), Táchira (Mun. Junin, Páramo de Tamá, Parque Nacional Tamá) y Trujillo (Mun. Boconó,
Páramo de Guaramacal) (Ramírez et al. 2009, Cuello et al. 2010, Briceño et al. 2010, Ely, comunicación personal).
El presente estudio se enfocó en dos poblaciones de C. mollis de la Sierra Nevada de Mérida, asociadas a
la vegetación de transición entre el bosque nublado montano alto y el páramo propiamente dicho denominado
bosque paramero o bosque pre-paramero (Ramírez et al. 2009). La estratificación y composición florística de esta
formación varía en función de la altitud y la orientación en la cordillera, pudiendo ser de tres o cuatro estratos.
Estudios florísticos previos realizados en el Páramo La Aguada, al Norte de la Cordillera por Yánez (1998), Berg & Suchi (2002), Ramírez et al. (2009) indican que esta formación se compone de árboles de altura variable, generalmente de 4-12 m representados por Podocarpus oleifolius, Ocotea calophylla, Schefflera rufa, Clusia multiflora, Cecropia santanderensis, Cybianthus marginatus, Drymis granadensis, Escallonia sp., Gaiadendron punctatum, Hedyosmum racemosum, Gynoxis meridana, Miconia latifolia, M. tinifolia, Oreopanax chrysoleucum, Vallea stipularis, Ugni myricoides y Weinmania glabra; helechos arborescentes como Cyathea caracassana, arbustos de 1,5-2,0 m de altura representados principalmente por Lybanothamnus lucidus, L. neerifolia, Psaamisia penduliflora, Themistoclesia dependens, Vaccinum meridionale, arbustos esclerófilos enanos (0,30-1,2 m) representados principalmente por Arcytophyllum nitidum, Chaetolepis lindeniana, Hesperomeles ferruginea, Hypericum laricifolium, Gaultheria myrsinoides, Pentacalia andicola y Valeriana parviflora, bambúes leñosos como Chusquea mollis y C. spencei, rosetas caulescentes, principalmente Espeletia schultzii y Ruilopezia atropurpurea, sufrútices como Monochaetum meridensis, M. humboldtianum y Monnina meridensis, hierbas erectas y prostradas, siendo las más comunes Lachemilla hirta, Lobelia ternera, Geranium chamaense y Orthosanthus chimboracensis, gramíneas en macolla como Calamagrostis effusa y Cortaderia nitida, helechos de los géneros Blechnum, Elaphoglossum y Jamesonia canescens y una importante diversidad de briófitos.
2.3. RECOPILACIÓN DE INFORMACIÓN FENOLÓGICA
Los registros de floración se basaron en información recopilada a partir de exicatas del herbario MERC (Instituto
Jardín Botánico, Facultad de Ciencias, Universidad de Los Andes), MER (Facultad de Ciencias Forestales y
Ambientales, ULA), MERF (Facultad de Farmacia y Bionálisis, ULA), PORT (Universidad Experimental de los
Llanos Ezequiel Zamora), VEN (Herbario Nacional, Fundación Instituto Botánico de Venezuela Tobías Lasser,
Universidad Central de Venezuela y las colecciones depositadas en el herbario MO (Missouri Botanical Garden),
disponibles en la base de datos TROPICOS (www.tropicos.org). La información obtenida a partir de observaciones
de campo se recaudó de salidas realizadas desde el año 2006-2018 al Páramo La Aguada (08°35ʹ N, 71° 09ʹO,
2800-3320 m snm) y el supáramo Las Coloradas (8°28´80,5¨N; 71°57´02,7¨O, 2700-2820 m snm), ambos forman
parte del Parque Nacional Sierra Nevada de Mérida, en la Cordillera de Mérida.
2.4. ESTUDIO POBLACIONAL
Los censos poblacionales se realizaron en el año 2018, en una población ubicada a 2930 m snm, asociada al bosque paramero que colinda con el Páramo la Aguada, adyacente a la estación del teleférico que lleva el mismo nombre. En dicha área, se censaron todos los individuos (plántulas, juveniles y adultos) presentes en dos parcelas de 10 m2, separadas 12 m lineales, ubicadas a lados opuestos del sendero principal. Sin embargo, también se contabilizaron individuos que crecían fuera de las parcelas a lo largo de un gradiente de elevación 2930-3200 m snm. Los individuos de Chusquea mollis forman macollas discretas, por lo que usualmente es relativamente sencillo distinguir un individuo de otro, particularmente en el caso de las plántulas e individuos juveniles.
Los individuos adultos pre y post-reproductivos se concentran en los claros naturales del bosque, creciendo junto a bambúes arbustivos como C. spencei y ocasionalmente con bambúes trepadores como C. aff. serrulata. En contraste, tanto las plántulas como los individuos juveniles de los primeros estadios (<3 años) crecen en las condiciones umbrófilas que proporciona el sotobosque del bosque paramero.
2.5. CARACTERÍSTICAS MICROCLIMÁTICAS DEL ÁREA DE ESTUDIO
La Estación La Aguada se ubica a 3452 m snm y forma parte del sistema Teleférico Mukumbarí, ubicado al norte de la ciudad de Mérida. El clima de La Aguada corresponde a un páramo húmedo, con un patrón de precipitaciones bimodal (Andressen y Ponte 1973). Los meses más lluviosos suelen ser mayo y octubre, los secos enero y febrero. La precipitación media anual en esta localidad es de 1811 mm; sin embargo, es probable que esta cifra haya incrementado en los últimos años, aunque no se disponen de registros continuos que apoyen esta afirmación. La temperatura media anual en la Estación La Aguada es de 7 °C, las temperaturas máximas promedio en horas de mediodía son 24 °C y la mínima registrada en horas de madrugada -0,9 °C. La humedad relativa en la Aguada promedio es de 76 %, pudiendo incrementar a 97 % en días lluviosos y descender a 60 % en días soleados.
Los suelos en el Parque Nacional Sierra Nevada son muy heterogéneos, corresponden a suelos jóvenes de tipo inceptisoles y entisoles, de textura franco a franco arenosa, ricos en materia orgánica y nitrógeno, de pH ligeramente ácido y baja capacidad de intercambio catiónico en general (Ramírez et al. 2009).
La información derivada de las escasas colecciones de herbario disponibles para esta especie se recopiló a partir de las colecciones depositadas en MERC, PORT y MO (Apéndice 1), puesto que no se encontraron exicatas de esta especie depositadas en los herbarios MER, MERF ni VEN. Los especímenes de C. mollis depositados en MERC proceden todos de páramos del Estado Mérida, ubicados en la Sierra Nevada de Mérida, específicamente los páramos La Aguada y Las Coloradas. Hasta la fecha, no se han localizado poblaciones creciendo en los páramos de Sierra La Culata, ni exicatas de la especie depositadas en herbarios locales, posiblemente por el hecho de que los páramos de dicha sierra son más secos, abiertos y también más intervenidos. La revisión realizada en la base de datos disponible en línea (www.tropicos.org) reveló la existencia de exicatas depositadas en MO procedentes de Colombia (Norte de Santander y Antioquia) y Venezuela (Mérida, Táchira, Trujillo).
Los registros de floración de C. mollis en los Andes venezolanos, obtenidos a partir de las colecciones de herbario y de los registros obtenidos en las salidas de campo aportan información para un lapso de 74 años, en el cual se han contabilizado un total de 17 eventos de floración para la especie; de los cuales 11 corresponden a registros de Venezuela (Fig. 1). En Venezuela, el 60 % de los eventos registrados corresponden a las poblaciones de los páramos La Aguada y Las Coloradas, ubicados en el Parque Nacional Sierra Nevada de Mérida, Estado Mérida.
La alta frecuencia con la que ocurren los eventos de floración, que sugieren intervalos muy cortos de 5-7 años (Fig. 1), aunque la ausencia de registros de floración correspondientes a los períodos 1997-2004, 2008-2012, 2014-2015 impiden determinar con exactitud la frecuencia y duración estos eventos. Basándonos en este registro, podríamos sugerir dos patrones de floración en C. mollis:
1- Patrón de floración gregario, en intervalos muy cortos (5-7 años), cuya duración se extiende de 1-3 años (Fig. 1), en cuyo caso se esperaría encontrar una estructura etaria relativamente homogénea en las poblaciones censadas.
2- Patrón de floración mixto, que involucra ciclos de floración gregarios que se solapan con eventos de floración asincrónicos aislados. La elevada frecuencia de eventos reproductivos, que combina ciclos sincrónicos y asincrónicos originan poblaciones heterogéneas, conformada por diferentes grupos etarios (juveniles de diferentes edades con adultos adultos pre y post reproductivos).
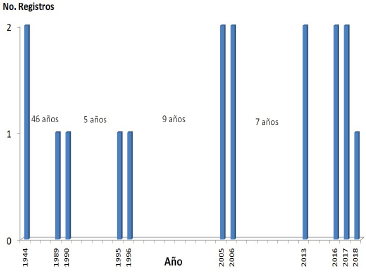
Figura 1. Eventos de floración registrados en poblaciones de C. mollis de la Cordillera de Mérida, Venezuela.
3.2. COMPOSICIÓN ETARIA DE LA POBLACIÓN DEL PÁRAMO LA AGUADA
Los censos preliminares realizados en el año 2018 revelaron una densidad de individuos relativamente baja en la población, de 152 individuos en el área total muestreada a lo largo de un gradiente de elevación de 62 m en La Aguada. La composición de la población resulto heterogénea, con representantes de todos los grupos etarios: plántulas (individuos de 5-10 cm de alto), juveniles en diferentes estados de desarrollo (20-100 cm), adultos jóvenes pre-reproductivos (130-180 cm), adultos en floración y adultos post-reproductivos senescentes (altura >2,0 m) (Figura 2 A-D). Sin embargo, es importante acotar que la representatividad de cada grupo en la población no fue equitativa, dado la mayor proporción de individuos estaba conformada por juveniles de diferentes edades (Figuras 3 A). El grupo de los adultos estaba conformado por un número variable de adultos jóvenes en estado vegetativo, adultos en floración y adultos en diferente estado de senescencia (post-reproductivos), cuya proporción era ligeramente mayor a la del resto del grupo de adultos (Figura 3 B).

Figura 2. A: Plántula en el sotobosque. B:Individuo juvenil. C: Adulto reproductivo. D: Adulto en estado vegetativo (pre-reproductivo).
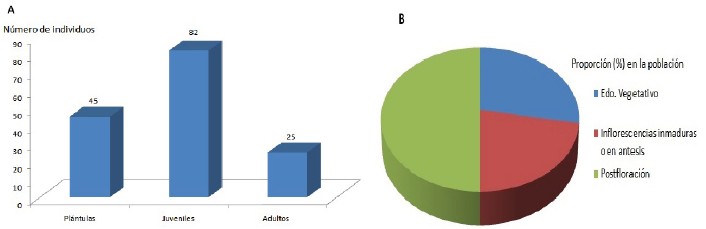
Figura 3. A: Número de individuos contabilizados de cada grupo etario en la población de Chusquea mollis ubicada en el páramo La Aguada durante los años 2017-2018. B: Proporción de individuos adultos en estado vegetativo, en estado reproductivo y post-reproductivo.
La alta proporción de juveniles respecto a los otros grupos sugiere la predominancia de ciclos de floración gregarios, que ocurren en intervalos cortos (5-7 años) que se extienden de 1-3 años, que se combinan con eventos de floración asincrónicos observados previamente en bambúes andinos pertenecientes al subgénero Swallenochloa (Judziewicz et al. 2009, Clark et al. 2015, González-Mora 2018, Ely comunicación personal) y en bambúes arbustivos del género Sasa en bosques montanos de Japón (Ma et al. 2013, Mizuki et al. 2014).
El ciclo de floración de C. mollis, de acuerdo a los resultados del presente estudio son más cortos que los reportados en bosques neotropicales andinos y Atlánticos (Pohl et al., 1982; Judziewicz et al., 1999; Clark & Ely, 2013; Montti et al., 2011; Guerreiro et al. 2014).
Aún cuando el presente estudio no contempló determinar la producción de frutos viables en C. mollis, se presume que es baja, dado que cada adulto fértil forma un mínimo de 2-4 sinflorescencias cuya longitud excede generalmente 1,0 m, y cada una porta un número elevado de espiguillas que deberían en conjunto aportar una lluvia de frutos abundante en el sitio, por lo que se esperaría encontrar bancos de plántulas más densos en las parcelas y en consecuencia, poblaciones con mayor densidad de individuos por superficie.
La viabilidad de los frutos en bambúes leñosos tiene una duración relativamente limitada, generalmente de pocas semanas (Judziewicz et al., 1999), por lo que la dispersión juega un papel muy importante. En la gran mayoría de los casos, los frutos caen al suelo cerca de la planta materna, con menor frecuencia, son dispersados por animales mediante epizoocoria (Judziewicz et al,. 1999). La producción de frutos puede variar mucho en los diferentes grupos de bambúes leñosos; con mucha frecuencia se encuentran poblaciones bambúes arbustivos del subgénero Swallenochloa como C. angustifolia, C. spencei y C. guirigayensis que producen inflorescencias que no forman cariopsis (Clark, 1989; Ely comunicación personal), lo cual confirma que no todos los genets aportan propágulos fértiles en la misma proporción durante los eventos de floración, dado que la producción de los frutos en bambúes leñosos también es influenciada por el fitness del genet (Matsuo et al., 2014).
También es importante tomar en cuenta otros factores que limitan la viabilidad de los frutos, así como el establecimiento y sobrevivencia de plántulas. Entre los principales factores que influyen en el reclutamiento de plántulas está la distribución espacial de los genets adultos, la estructura del sotobosque, la temperatura del aire y del suelo al momento de la dispersión y la radiación incidente que reciben las plántulas durante su fase de establecimiento (Muñoz et al., 2012; De La Fuente & Pacheco, 2017; Matsuo et al., 2018).
Estudios ecofisiológicos preliminares en juveniles y adultos de esta especie en el sitio de estudio indican que tanto las plántulas como las juveniles que ocupan el estrato más bajo del sotobosque reciben niveles de radiación bajos (60-80 µmol fotón m-2 s-1) debido a que la vegetación del bosque paramero intercepta una proporción muy alta de la radiación incidente, la cual as vez está afectada por la elevada nubosidad que caracteriza los páramos húmedos como La Aguada (González-Figueroa, 2019). Por lo tanto, es factible que tanto la calidad como la cantidad de radiación incidente contribuyan regular la densidad poblacional de C. mollis. Sin embargo, es fundamental realizar un estudio de viabilidad de los frutos detallado, aunado a un seguimiento regular del desarrollo de los individuos de los diferentes grupos etarios, así como estudios microclimáticos en el sitio para determinar con mayor precisión los factores que limitan la densidad poblacional en esta especie. También es aconsejable continuar censos poblacionales de esta especie, en diferentes localidades, en intervalos regulares, con el objeto de comprender con mayor precisión su dinámica poblacional y regeneración en ecosistemas andinos.
Los estudios fenológicos durante períodos de tiempo extendidos en ecosistemas de alta montaña pueden resultar complejos, ya sea por dificultades para acceder a los sitios de observación, o por la aparición inesperada de factores imprevistos como perturbaciones naturales o de origen antrópico que afectan las poblaciones de estudio. En el caso específico de los Andes venezolanos, este último factor ha cobrado mucho peso a causa del progresivo avance de la frontera agrícola y asentamientos humanos desde comienzos del siglo XX, que han originado la sustitución de una parte importante de la vegetación autóctona por cultivos de rubros alimenticios, ganadería de altura la extracción de leña (Monasterio and Molinillo 2003, Ely comunicación personal).
La formación boscosa y el páramo al Norte del Parque Nacional Sierra Nevada, adyacente a la estación La Aguada está actualmente muy conservada, a diferencia de la porción sur del al misma formación montañosa, donde se ubica el subpáramo Las Coloradas; que pese a formar parte del mismo parque nacional, no ha recibido el mismo estatus de área protegida; en consecuencia, el bosque paramero se encuentra severamente fragmentado y alterna con pastizales de altura, originados por la eliminación de grandes porciones de bosque para el establecimiento de la ganadería de altura, cultivos y extracción de leña (Ely, comunicación personal).
Tomando en consideración la distribución restringida y el tamaño limitado de las poblaciones de esta especie en la Cordillera de Mérida, se recomienda realizar un seguimiento de las poblaciones de C. mollis en los Andes venezolanos, e implenetar medidas destinadas a proteger y conservar los páramos húmedos, que representan el único hábitat de esta especie.
Abe, Y., Shibata, S. (2012). Spatial and temporal flowering patterns of the monocarpic dwarf bamboo Sasa veitchii var. hirsuta. Ecological Research. DOI: org/10.1007/s11284-012-0933-9.
Berg, A. & Suchi, S. (2002). La vegetación de los Páramos La Aguada, La Fría y Espejo en Los Andes Venezolanos. Plantula, 3(1), 47-64.
Clark, L.G. (1989). Systematics of Chusquea Section Swallenochloa, Section Verticillatae, Section Serpentes and Section Longifoliae (Poaceae-Bambusiodeae). Systematic Botany Monographs, 27, 1-127.
Clark L.G., Ely F. (2011). Géneros de bambúes (Poaceae: Bambusoideae: Arundinarieae, Bambuseae) leñosos de Venezuela. Acta Botánica Venezuélica, 34(1), 79-103.
Clark L.G., Ely, F. 2013. Two New Species of Chusquea (Poaceae: Bambusoideae: Bambuseae) from Venezuela and a Redescription of Chusquea purdieana. Systematic Botany, 38,1–9. doi 10.1600/036364413X674922.
Clark, L.G., Londoño, X. & Ruiz-Sanchez, E. (2015). Bamboo Taxonomy and Habitat. En: Liese, W., Köhl, M. (Ed.). Bamboo, the plant and its uses. Heidelberg, Germany, Springer Verlag. Tropical Forestry Series, 10: 1-30. doi 10.1007/978-3-319-14133-6_1.
Cuello, N. & A. M. Cleef (2009). The páramo vegetation of Ramal de Guaramacal, Trujillo State, Venezuela. 1. Zonal communities. Phytocoenologia, 39 (3), 295–329. 1926.
Cuello, N. L., Cleef, A. M.& Aymard, G. (2010).Phytogeography of the vascular páramo flora of Ramal de Guaramacal (Andes, Venezuela) and its ties to other páramo floras. Anales del Jardín Botánico de Madrid, 67(2), 177-193.
Dalagnol, R., Wagner, F. H., Galvão, L. S., Nelson, B. W., L. E., Oliveira & Aragão de, C. (2018). Life cycle of bamboo in the southwestern Amazon and its relation to fire events. Biogeosciences 15, 6087–6104. DOI: 10.5194/bg-15-6087-2018
De la Fuente, A. & Pacheco, N. (2017). Biomasa, producción de semillas y fenología de Chusquea montana tras su floración masiva y sincrónica en el Parque Nacional Puyehue, Chile. Bosques, 38(3): 599-604. DOI: 10.4067/ S0717-92002017000300018
Ely, F., Rada, F., Fermin, F., Clark, L. G. (2019). Ecophysiology and genetic diversity in species of the bamboo Chusquea in the high Andes, Venezuela. Plant Ecology and Diversity. DOI: 10.1080/17550874.2019.1673847.
Ely, F., Clark, L. G. En prensa. Bambúes amenazados de la flora Venezolana. Aceptado en el Libro Rojo de la Flora Venezolana, segunda edición, que publicará la gerencia de Desarrollo e Investigación de la Fundación Instituto Botánico de Venezuela.
Fadrique, B., Pianissola, E. M., Feeley, K. J., & Clark, L. G. (2019). A preliminary revision of Chusquea sect. Swallenochloa (Bambuseae, Bambusoideae, Poaceae) in Peru including the description of two new species and the resurrection of two other species. Phytotaxa, 418(2), 171-194.
Fisher, A.E., Triplett, J.K., Ho, C.S., Schiller, A.D., Oltrogge, K.A., Schroder, E.S., Kelchner, S.A. & Clark, L. G. (2009). Paraphyly in the bamboo subtribe Chusqueinae (Poaceae: Bambusoideae) and a revised infrageneric classification for Chusquea. Systematic Botany, 34. 673–683.
Fisher, A.E., Clark, L. G., Kelchner, S. A. (2014). Molecular Phylogeny Estimation of the Bamboo Genus Chusquea (Poaceae: Bambusoideae: Bambuseae) and Description of Two New Subgenera. Systematic Botany. doi: 10.1600/036364414X681554.
Franklin, D.C. (2004) Synchrony and asynchrony: observations and hypotheses for the flowering wave in a longlived semelparous bamboo. Journal of Biogeography 31: 773–778.
González-Figueroa, J. V. (2019). Respuesta Ecofisiológica y estructura morfoantómica foliar de individuos juveniles y adultos de Chusquea spectabilis LG Clark (Subgénero Magnifoliae, Bambusoideae, Bambusae, Poaceae). Trabajo especial de Grado de para optar al título de Licenciado en Biología, Facultad de Ciencias. Universidad de Los Andes, Mérida, Venezuela.
González-Mora, R. D. (2018). Variabilidad genética intra-poblacional de Chusquea guirigayensis Niño, L. G. Clark & Dorr, en el Páramo Piedras Blancas - Los Romeros (Mérida, Venezuela). Trabajo especial de Grado de para optar al título de Licenciado en Biología, Facultad de Ciencias. Universidad de Los Andes, Mérida, Venezuela.
Guerreiro, C. (2014). Flowering cycles of woody bamboos native to southern South America. Journal of Plant Research. doi: 13.1007/s10265-013-0593-z.
Insuasty-Torres, J. (2015). Variacion espacio-temporal de la estructura poblacional de Chusquea tessellata Munro (Poaceae: Bambusoideae) a lo largo de un gradiente altitudinal en el parque nacional natural Chingaza. Univerisdad Nacional de Colombia, Bogotá, Colombia
Judziewicz, E. J., Clark, L. G., Londonño X. & Stern, M. J. (1999). American Bamboos. Washington, D. C.: Smithsonian Institution.
Kitamura, K., Kawahara, T. (2009). Clonal identification by microsatellite loci in sporadic flowering of a dwarf bamboo species, Sasa cernua. Journal of plant Research. doi: 10.1007/s10265-009-0220-1.
Ma, Q., Q., Song, H. X., Zhou, S. Q., Yang, W.Q., Li, D. S. & Chen, J. S. (2013).Genetic Structure in Dwarf Bamboo (Bashania fangiana) Clonal Populations with Different Genet Ages. PLoS ONE 8(11): doi:10.1371/journal. pone.0078784.
Makita, A. (1998). The Significance of the Mode of Clonal Growth in the Life History of Bamboos. Plant Species Biology, 13,85-92.
Matsuo, A., Tomimatsu, H., Suzuki, J.I., Saitoh, T., Shibata, S., Makita, A., Suyama, S. (2014). Female and male fitness consequences of clonal growth in a dwarf bamboo population with a high degree of clonal intermingling. Annals of Botany, 114,1035–1041.doi:10.1093/aob/mcu176.
Matsuo, A., Tomimatsu, H., Sangetsu, Y., Suyama, Y., Makita, A. (2018). Genet dynamics of a regenerating dwarf bamboo population across heterogeneous light environments in a temperate forest understory. Ecology & Evolution 2018: 1-2. DOI: DOI: 10.1002/ece3.3793
Miyazaki, Y., Ohnishi, N., Takafumi, O., Hiura, T. (2009). Genets of dwarf bamboo do not die after one flowering event: Evidence from genetic structure and flowering pattern. Journal of Plant Research 122(5):523-8. DOI: 10.1007/s10265-009-0241-9
Mizuki, I., Sato, A., Matsuo, A., Suyama, Y., Suzuki, J-I., Makita, A. (2014). Clonal Structure, Seed Set, and Self- Pollination Rate in Mass-Flowering Bamboo Species during Off-Year Flowering Events. PLoS ONE9: e105051. DOI:10.1371/journal.pone.0105051
Monasterio, M. & Molinillo, M. (2003). Los páramos de Venezuela. En: Hofstede, R., Segarra, P., Mena, M. (Ed.). Los páramos del mundo. Quito, Ecuador. Proyecto Atlas Mundial de los Páramos. Global Peatland Iniciative/ NC-IUCN/Ecociencia. p. 205-236.
Montti, L., Campanello, P.I., Gatti, M.G., Blundo, C., Austin, A.T., Sala, O.E. & Goldstein, G. (2011).Understory bamboo flowering provides a very narrow light window of opportunity for canopy-tree recruitment in a neotropical forest of Misiones, Argentina. Forest Ecology and Management, 261,1360-1369. doi: 10.1016/j. foreco.2011.06.029.
Muñoz, A. A,, González, M. E., Celedón, C. & Veblen, T. T., Respuesta inicial de la regeneración arbórea luego de la floración y muerte de Chusquea culeou (Poaceae) en bosques andinos del centro-sur de Chile. Bosque, 33, 2, 153-162, 2012 DOI: 10.4067/S0717-92002012000200005.
Pearson, A.K., Pearson, O.P. & Gómez, I. (1994). Biology of the bamboo Chusquea culeou (Poaceae, Bambusoideae) in southern Argentina. Vegetatio, 111, 93-126.
Pohl, R. (1982). On the flowering of bamboos in Central America. Brenesia, 19/20: 465-475.
Ramírez, L., Llambí, L. D., Schwarzkopf, T., Gámez, L. E. & N. J. Márquez. (2009). Vegetation structure along the forest – páramo transition belt in the sierra nevada de mérida: implications for understanding treeline dynamics. ECOTROPICOS, 22, 2: 83-98.
Tachiki, Y., Makita, A., Suyama, Y., Satake, A. (2015). A spatially explicit model for flowering time in bamboos: long rhizomes drive the evolution of delayed flowering. Journal of Ecology, 103, 585–593. DOI: 10.1111/1365- 2745.12390.
Vorontsova, M.S., Clark, L.G., Dransfield, J., Govaerts, R. & Baker, W.J. (2016) World Checklist of Bamboos and Rattans. INBAR
Technical Report No. 37. International Network of Bamboo & Rattan, Beijing, China, 466 pp.
Wang, W., Franklin, S. B., Lu, Z., Rude, B. J. (2016) Delayed Flowering in Bamboo: Evidence from Fargesia qinlingensis in the Qinling Mountains of China. Frontiers in Plant Science. DOI: 10.3389/fpls.2016.00151
Wysocki, W.P., Ruiz-Sanchez, E., Yin, Y., Duvall, M. (2016). The floral transcriptomes of four bamboo species (Bambusoideae; Poaceae): support for common ancestry among woody bamboos. BMC Genomics 17, 384. DOI:10.1186/s12864-016-2707-1
Yánez, P. (1998). Caracterización florística en un sector de cambio páramo- selva nublada en el parque nacional Sierra Nevada, Venezuela. Revista Forestal Venezolana, 42(1), 51-62.
Zhang, X. M., Zhao, L., Larson-Rabin, Z., Li, D. Z., Guo, Z. H. (2012). De Novo sequencing and characterization of the floral transcriptome of Dendrocalamus latiflorus (Poaceae: Bambusoideae). PLoS ONE 7:e42082. DOI: 10.1371/journal.pone.0042082
Zeng, H. Y., Lu, Y. T., Yang, X. M., Xu, Y. H., and Lin, X. C. (2015). Ectopic expression of the BoTFL1-like gene of Bambusa oldhamii delays blossoming in Arabidopsis thaliana and rescues the tfl1 mutant phenotype. Genet. Mol. Res. 14, 9306–9317. DOI: 10.4238/2015.August.10.11.
APÉNDICE 1. Exicatas de herbario de Chusquea mollis.
1- COLOMBIA.
1.1. Santander: E.P. Killip & Albert C. Smith 15830, 1926, MO.
1.2. Santander: L.G. Clark & J. Cavalier 291, 1982, MO , L.G. Clark 296, 1982, MO.
1.3. Antioquia: J.M. MacDougal, F. J. Roldán & J.C. Betancur, 1989, MO.
2- VENEZUELA.
2.1. Mérida: J. Steyermark 56512, 1944 MO; Ricardi et al. s/n, 1989, MERC; Ely et al. 38, 43, 2006, MERC; Ely et al. 48, 2013, MERC, Ely et al. 53, 2017, MERC.
2.2. Táchira: 1944, J. Steyermark 57199, 57400, MO.
2.3. Trujillo. L.J. Dorr et al. 7368, 1990, MO.

![]()
© Universidad de las Fuerzas Armadas ESPE Sangolquí, Ecuador. CIENCIA - QUITO, Volumen 22, No. 1, Enero 2020
ISSN: 1390-1117, ISSN en línea: xxx-xxx.
Revista Trimestral- 50 ejemplares
“THIS IS AN OPEN ACCESS ARTICLE UNDER THE TERMS OF THE CREATIVE COMMONS ATTRIBUTION LICENSE, WHICH PERMITS USE, DISTRIBUTION AND REPRODUCTION IN ANY MEDIUM, PROVIDED THE ORIGINAL WORK IS PROPERLY CITED.”